Nous allons explorer ce qu’est l’ozone et ce qu’est le rayonnement ultraviolet. Nous explorerons ensuite la relation entre l’ozone et les rayons ultraviolets du soleil.
L’ozone joue un rôle essentiel pour protéger la vie sur la Terre en filtrant les rayonnements ultraviolets nocifs provenant du soleil.
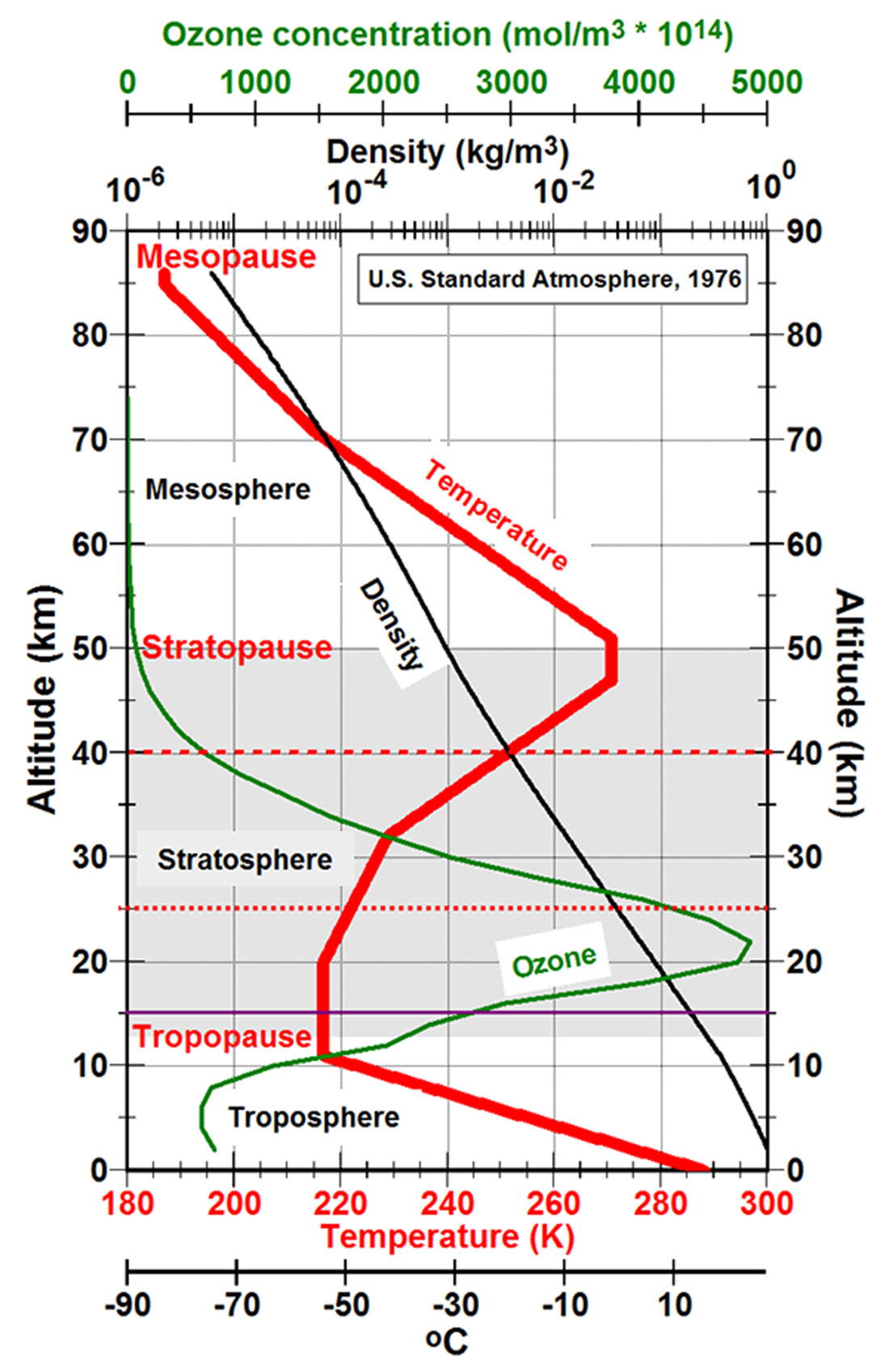
Environ 90% de l’ozone de notre atmosphère est contenu dans la stratosphère, la région située à environ 10 à 50 km au-dessus de la surface de la Terre. Dix pour cent de l’ozone est contenu dans la troposphère, la partie la plus basse de notre atmosphère où les mouvements météorologiques ont lieu. Les mesures prises à partir d’instruments au sol, effectuées sur des ballons et opérant dans l’espace montrent que les concentrations d’ozone sont les plus élevées entre environ 15 et 30 km. La courbe jaune de la figure ci-dessous montre comment la quantité d’ozone varie avec l’altitude. Ce type de tracé est appelé profil vertical.

Il existe trois types différents de rayonnement ultraviolet (UV), en fonction de la longueur d’onde du rayonnement.
- UV-a,
- UV-b
- UV-c.
La figure du dessus montre également jusqu’où pénètre dans l’atmosphère chacun de ces trois types de rayonnement UV. On voit que l’UV-c (rouge) est entièrement filtré par l’ozone à environ 35 km d’altitude. D’un autre côté, nous voyons que la plupart des UV-a (bleus) atteignent la surface, mais ce n’est pas aussi dommageable pour la vie sur terre, donc nous ne nous en préoccupons pas trop.
C’est le rayonnement UV-B (vert) qui peut causer des coups de soleil et qui peut également entrainer des dommages plus graves se traduisant par le cancer de la peau, si l’exposition est prolongée. L’ozone supprime la plupart des UV-b, mais certains atteignent la surface. Si la couche d’ozone diminuait, davantage de rayonnement UV-B atteindrait la surface, causant des dommages génétiques accrus sur les organismes vivants.
La «couche» d’ozone n’est pas une couche statique de gaz, mais une région dans l’atmosphère où suffisamment de rayonnement ultraviolet solaire à haute énergie est disponible pour former et détruire l’ozone dans un cycle sans fin (le cycle Chapman). Chacune de ces étapes réchauffe la stratosphère (voir courbe rouge sur la figure ci-dessous). La durée de vie d’une molécule d’ozone dans la stratosphère peut être aussi courte que quelques secondes mais elle est d’environ 22 jours dans la basse troposphère. Lorsque la quantité normale d’ozone est épuisée pour une raison quelconque, une partie de l’énergie ultraviolette solaire qui l’anime n’est pas absorbée dans la stratosphère mais pénètre dans la Terre où les océans l’absorbent très efficacement, refroidissant la stratosphère et réchauffant la Terre.
Les éruptions volcaniques explosives majeures forment des aérosols dans la basse stratosphère qui réfléchissent et dispersent la lumière du soleil, refroidissant la Terre d’environ 0,5 ° C sur quelques années. Ces éruptions explosives appauvrissent également l’ozone, réchauffant la Terre en hiver, mais le refroidissement causé par les aérosols prédomine.
Structure de l’ozone
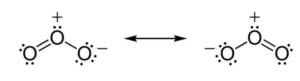
Selon les résultats expérimentaux de la spectroscopie micro-ondes, l’ozone est une molécule courbe, avec une symétrie C2v (similaire à la molécule d’eau). Les distances O-O sont de 1,272 Å. L’angle O-O-O est de 116,78 °. C’est une molécule polaire avec un moment dipolaire de 0,53 D. La molécule peut être représentée comme un hybride de résonance avec deux structures contribuantes, chacune avec une simple liaison d’un côté et une double liaison de l’autre.
L’ozone est l’un des agents oxydants les plus puissants connus, bien plus puissant que l’O2. Il est également instable à des concentrations élevées, se désintégrant en oxygène diatomique ordinaire. Sa durée de demi-vie varie en fonction des conditions atmosphériques (température, humidité et mouvement de l’air). Dans une chambre étanche avec un ventilateur qui déplace le gaz, l’ozone a une demi-vie d’environ un jour à température ambiante.