Presque tout composé ayant des liaisons covalentes, qu’elles soient organiques ou inorganiques, absorbe diverses fréquences de rayonnement électromagnétique dans la région infrarouge du spectre électromagnétique.
Cette région se situe à des longueurs d’onde plus longues que celles associées à la lumière visible, qui vont d’environ 400 à 800 nm (1 nm = $10^{-9}$ m), mais à des longueurs d’onde plus courtes que celles associées aux micro-ondes supérieures à 1 mm.
Dans le domaine chimique, nous nous intéressons à la partie vibrationnelle de la région infrarouge. Cette région comprend un rayonnement de longueur d’onde ($\lambda$) compris entre $2.5 \mu m$ et $25 \mu m$ ($1 \mu m$ = $10^{-6}$ m).
Bien que l’unité la plus techniquement correcte pour la longueur d’onde dans la région infrarouge du spectre soit le micromètre ($\mu m$), on utilise plutôt le micron ($\mu$) utilisé sur les spectres infrarouges.
La figure suivante illustre la relation de la région infrarouge avec d’autres éléments inclus dans le spectre électromagnétique.
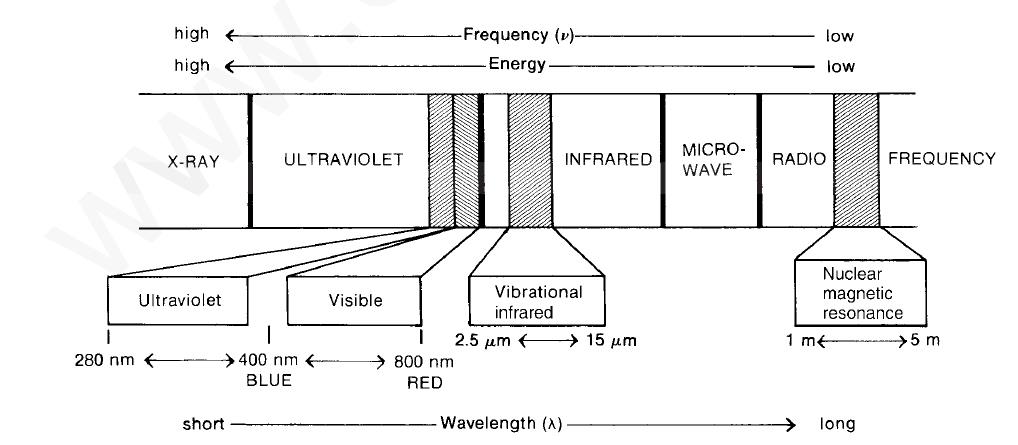
La figure ci-dessus montre que la longueur d’onde $\lambda$ est inversement proportionnelle à la fréquence $\nu$ et est régie par la relation $\nu = c/ \lambda$, où c = vitesse de la lumière.
Observons également que l’énergie est directement proportionnelle à la fréquence: E = $\hbar\nu$, où $\hbar$ = constante de Planck. À partir de cette dernière équation, vous pouvez voir qualitativement que le rayonnement d’énergie la plus élevée correspond à la région de rayons X du spectre, où l’énergie peut être assez grande pour rompre les liaisons dans les molécules.
À l’autre extrémité du spectre électromagnétique, les radiofréquences ont des énergies très faibles, seulement suffisantes pour provoquer des transitions de spin nucléaires ou électroniques dans les molécules, ce qui correspond aux techniques de résonance magnétique nucléaire (RMN) ou de résonance de spin électronique (ESR).
Le tableau suivant résume les régions du spectre et les types de transitions d’énergie qui y sont observées.
TYPES DE TRANSITIONS D’ENERGIES DANS CHAQUE REGION DU SPECTRE ELECTROMAGNETIQUE
| Région du spectre | Transitions d’énergie |
|---|---|
| Rayons X</td> | Cassure de liaisons |
| Rayons UV – visible | Electrons |
| Rayons infra-rouge | vibrationnelle :
|
| Rayons micro-onde | rotationnelle |
| Radio-fréquence | spin nucléaire (RMN) spin électronique(ESR) |
Plusieurs de ces régions, y compris l’infrarouge, donnent des informations vitales sur les structures des molécules organiques. La résonance magnétique nucléaire, qui se produit dans la partie radiofréquence du spectre, est traitée aux chapitres 3, 4, 5, 6 et 10, tandis que la spectroscopie ultraviolette et visible est décrite au chapitre 7.
La plupart des chimistes se réfèrent au rayonnement dans la région infrarouge vibrationnelle du spectre électromagnétique en termes d’une unité appelée un nombre d’onde ($\nu$), plutôt que longueur d’onde (m ou mm).
Comme avec d’autres types d’absorption d’énergie, les molécules sont excitées à un état d’énergie plus élevé lorsqu’elles absorbent le rayonnement infrarouge. L’absorption du rayonnement infrarouge est, comme d’autres processus d’absorption, un processus quantifié. Une molécule n’absorbe que les fréquences sélectionnées (énergies) du rayonnement infrarouge. L’absorption du rayonnement infrarouge correspond à des changements d’énergie de l’ordre de 8 à 40 kJ / mole.
Le rayonnement dans cette plage d’énergie correspond à la gamme englobant les fréquences vibratoires d’étirement et de flexion des liaisons dans la plupart des molécules covalentes. Dans le processus d’absorption, les fréquences de rayonnement infrarouge qui correspondent aux fréquences vibrationnelles naturelles de la molécule en question sont absorbées, et l’énergie absorbée sert à augmenter l’amplitude des mouvements vibratoires des liaisons dans la molécule. Notez, cependant, que toutes les liaisons dans une molécule ne sont pas capables d’absorber l’énergie infrarouge, même si la fréquence du rayonnement correspond exactement à celle du mouvement de la liaison. Seules les liaisons dont le moment dipolaire change en fonction du temps sont capables d’absorber le rayonnement infrarouge. Les liaisons symétriques, telles que celles de H2 ou Cl2, n’absorbent pas le rayonnement infrarouge. Une liaison doit présenter un dipôle électrique qui change à la même fréquence que le rayonnement entrant pour l’énergie à transférer. Le dipôle électrique changeant de la liaison peut alors s’accorder avec le champ électromagnétique sinusoïdal du rayonnement entrant. Ainsi, une liaison symétrique qui a des groupes identiques ou presque identiques à chaque extrémité n’absorberont pas dans l’infrarouge.
Pour les besoins d’un chimiste organique, les liaisons les plus susceptibles d’être affectées par cette restriction sont celles des alcènes symétriques ou pseudosymétriques (CJC) et des alcynes (CKC).